治験や臨床研究について。その仕組みを知りたい。
これまでのマナビラボでは、再生医療によってどのような病気やケガが治療できるのか、それらの治療はどこで受けることができるのかを学びました。それらの中で、特に保険が適用される再生医療については、多くの試験によって安全性と有効性を証明し、厚生労働省に承認を受ける必要があります。今回のマナビラボでは、再生医療が承認されるまでの流れ、そして日本独自の承認制度について学びましょう。
再生医療が承認されるまで
医薬品の承認の流れについては、みなさんも何となく聞いたことがあるのではないでしょうか?
再生医療も基本的には同じ流れで、大きく分けると
①基礎研究 → ②非臨床試験 → ③治験(臨床試験) → ④申請
という4段階になります。
それぞれの段階でどういったことをするのか見ていきましょう。
①基礎研究:
新しい治療法の開発の第一歩です。対象とする病気やけがに対して、どのような細胞をどのような形で使えばよいかを考え、その効果を細胞培養や動物実験で確かめます。通常2-3年かかります。
②非臨床試験:
実際に人に投与や治療を行う試験のことを「臨床試験」といいます。そのための準備段階が「非臨床試験」です(「前臨床試験」とも呼ばれます)。本当に人に投与しても大丈夫かどうか、安全性や有効性について、より詳細に調べます。通常3-5年かかります。
③治験:
実際に人に投与や治療をして、治療効果と安全性を確かめる段階です。臨床試験の中で、厚生労働省への申請のために行う試験のことを「治験」と呼びます。通常、3-7年かかります。
④申請:
厚生労働省へ申請して、承認が下りれば保険適用の治療として実施することができます。
治験の流れ
この中で、治験についてもう少し詳しく見てみましょう。
こちらも耳にしたことがあるかもしれませんが、治験は第1相、第2相、第3相と分けられます(フェーズ1, フェーズ2…という呼び方をされることもあります)。
第1相:
安全性を調べる段階です。実際の治療より少ない量の薬や細胞を使って、副作用がないか、投与した薬や細胞がきちんと目的の部位に届くか、などが調べられます。
第2相:
治療効果や投与量を確認する段階です。治療効果が得られ、かつ副作用の出ない投与量を確認します。
第3相:
最終段階です。多くの患者様に治療を行い、治療効果や安全性を最終的に確認します。
治験の実施には、治験審査委員会の許可を得る必要があります。そのためには、薬や細胞の詳細、非臨床試験で得られた安全性や有効性についての多くのデータ、治験の実施体制、万が一副作用が見られた場合の対処法など、数百ページに渡る多くの書類の提出が求められます。治験で予想外に副作用が出てしまう可能性は0ではありませんが、そのようなことが可能な限り起こらないように、十分に審査された上で治験は行われています。
日本独自の制度:条件・期限付き早期承認制度

このように1つの医薬品が承認されるには、多くの試験と厳しい審査を受けるが必要があるため、1つの薬が承認されるまでには10-15年の時間と数百億円の費用がかかります。再生医療の場合には、通常の治療では効果がない患者様が対象となるため、通常の医薬品に比べて患者数が少なく参加者が集まりにくく、さらに長い時間がかかってしまいます。
そこで2014年にできた制度が「条件・期限付き早期承認制度」です。この制度は重篤な疾患に対する再生医療で、患者数が少ない等の理由で治験の実施に長い時間を必要とするものに対して、「安全性が確かめられて、かつ有効性が推定できるものについて、条件・期限付きで承認を与える」というもので、運転免許でいう仮免許のような制度です。条件としては、設備が整った施設でその治療法について精通した医師が行うことなどが求められ、決められた期限(通常5年間)までに、有効性を証明するデータを揃えて再度申請することで、正式な承認を得ることができます。
この制度によって、第2相までの治験での申請が可能となり、承認までの時間が大幅に短縮されました。
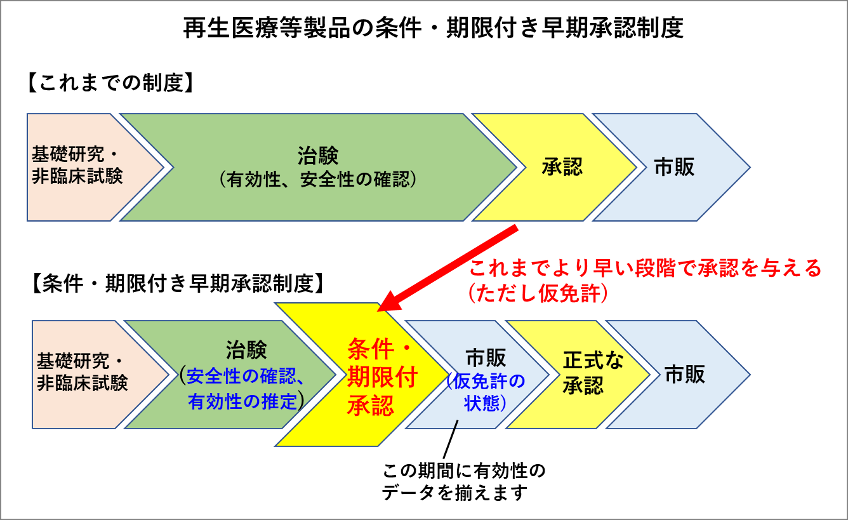
この制度は世界に先駆けて日本で作られた日本独自の制度です。この制度によって、より早く患者様の元へ最新の治療を届けることができるようになりました。2014年当時は再生医療等製品のみが対象でしたが、2017年からは医薬品や医療機器も対象となっています(すべての医薬品・医療機器が対象ではなく重篤でほかに治療法のない疾患に限られています)。
しかしながら、海外からは「仮免許とは言え、有効性が確認できていないものを承認してよいのか」といった批判の声も上がっています。その意見ももっともですが、一方で、新しい治療法を1日でも早く受けたいと多くの患者様が待ち望んでいることも事実ですし、どちらがよいかは一概には言えません。まだできたばかりの制度ですし、これからの状況により変更を加えながら、よりよい制度となることを期待しています。
臨床試験/治験について詳しく知りたい場合
この記事を読んでくださっている方の中には、ご自身もしくはご家族など周りの方が臨床試験や治験の参加に興味を持っているという方もいらっしゃるかもしれません。そこで、最後に臨床試験や治験の情報の調べ方について説明します。
治験を含む臨床試験は、まだ一般的に行われていない最新の治療を受けることができる数少ない機会ですし、治療費も実施する側の負担となるため、経済的な負担なく治療を受けることができます。ただし、有効性や安全性を確認するための試験ですので、必ずしも期待通りの効果が得られる保証はなく、また副作用が生じる可能性も0ではありません。さらに、臨床試験中は通常の治療時に比べて血液検査などの検査回数が多く、体への負担も比較的大きくなります。
このように必ずしも良い面ばかりではありませんが、まずはどのような臨床試験が行われているか興味がある場合は、国立保健医療科学院のウェブサイトで調べることができます。
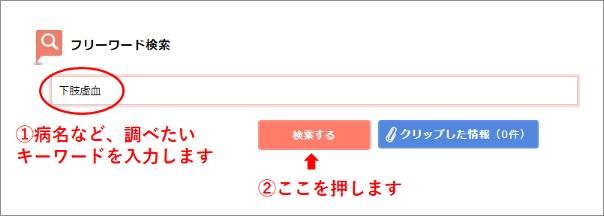
例として、「下肢虚血」の臨床試験を調べてみましょう。上記のホームページにある「フリーワード検索」に、病名など調べたいキーワードを入力して、「検索する」を押します。
そうすると、「下肢虚血」に関連する臨床試験の一覧が出てきます。ただし、この中にはすでに終了したものや中止になった試験も含まれますので、画面右の欄で「進捗状況」や、また年齢・性別などの条件を絞って検索することもできます。
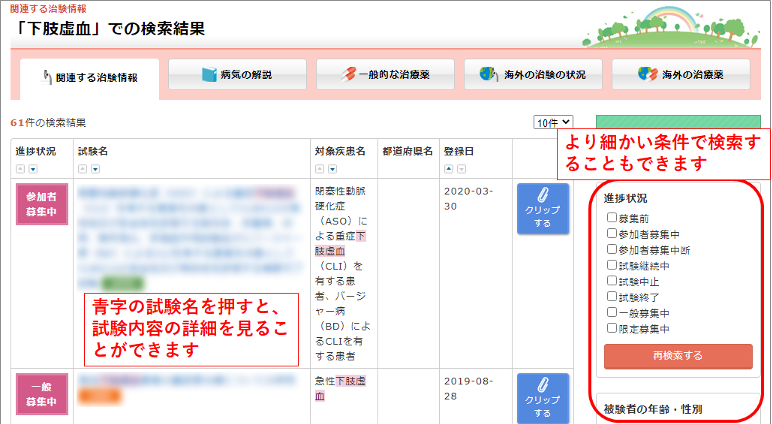
この画面で青字の「試験名」を押すと、試験の内容や対象疾患、実施機関などの詳しい情報を見ることができます。
また、ページの一番下に「問い合わせ窓口」が載っていますので、臨床試験についてより詳しいことを知りたい場合は、そこにある連絡先に直接、もしくは普段治療を担当している医師を介して連絡を取ってみてください(申し訳ございませんが、当機構からの紹介はできません)。
今月の学び
1つの薬や治療法が承認されるためには、3段階の「治験」によって安全性と有効性を確かめる必要があり、治験だけで3-7年以上の時間がかかります。そこで、再生医療については日本独自の制度である「条件・期限付き早期承認制度」が制定され、治験にかかる時間を大幅に短縮することで、患者様により早く新しい治療を届けることができるようになりました。
